

Bij kinderen met ongecontroleerde, matig-ernstig tot ernstig astma heeft circa 85% astma met type 2-inflammatie, waarbij het aantal bloedeosinofielen ≥150/µl is of FeNO ≥20 ppb is. De meeste van deze kinderen vertonen daarbij een allergisch fenotype. Het monoklonale antilichaam dupilumab richt zich op de centrale aandrijvers van T2-inflammatie en kan daarom mogelijk ook effectief zijn bij deze groep van pediatrische astmapatiënten. Tijdens EAACI 2022 werden door prof. dr. Eckard Hamelmann (Ruhr-Universität Bochum, Klinik für Kinder- und Jugendmedizin, Bochum, Duitsland) de resultaten gepresenteerd van een post-hocanalyse van de VOYAGE-studie, waarin de effectiviteit van dupilumab werd vergeleken tussen pediatrische astmapatiënten met of zonder een allergisch fenotype.
De deelnemers, kinderen van 6-11 jaar met ongecontroleerde, matig-ernstig tot ernstig astma met T2-inflammatie, werden op basis van IgE-niveaus onderverdeeld in niet-allergisch, mono-allergeengesensitiseerd of multi-allergeengesensitiseerd. Patiënten ontvingen dupilumab als aanvullende behandeling (gerandomiseerd elke 2 weken 100 of 200 mg per kg lichaamsgewicht) voor een periode van 52 weken. De belangrijkste uitkomsten waren de jaarlijkse ernstige astma-exacerbatiefrequentie (‘annualized severe asthma exacerbation rate’, AER) en de verandering in pre-bronchodilatator (pre-BD) FEV1pp vanaf aanvang van de studie.
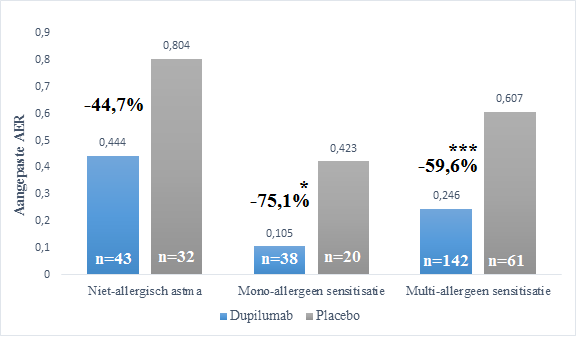
In totaal werd de aandoening van 261 deelnemers (78%) geclassificeerd als allergisch astma, waarbij er bij 58 kinderen één type allergeenspecifiek IgE werd aangetoond en bij 203 meerdere typen allergeenspecifiek IgE. Uit de analyse bleek dat in alle drie de groepen dupilumabbehandeling resulteerde in een afname van de AER ten opzichte van placebo, maar bij niet-allergisch astma was dit verschil niet significant (p=0,143). Bij mono-allergeengesensitiseerde patiënten werd wel een significante afname in de exacerbatiefrequentie gezien: een verschil van 75,1% (p=0,04) in AER tussen dupilumab en placebo (zie Figuur 1). Bij patiënten die gesensitiseerd waren voor meerdere allergenen werd ook een significant lagere AER aangetoond met dupilumabbehandeling ten opzichte van placebo. Bij hen was de AER 59,6% lager (p<0,001) tijdens de studieperiode. Bij niet-allergische astmapatiënten was een niet-significante trend van een reductie in AER zichtbaar met een verschil van 44,7% tussen dupilumab en placebo.
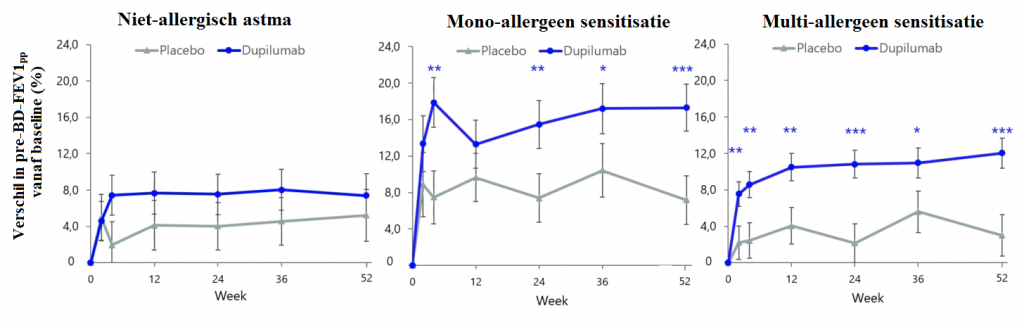
Bij het evalueren van de pre-BD-FEV1ppwerd vastgesteld dat behandeling met dupilumab resulteerde in een significante verbetering van deze uitkomst bij astmapatiënten die gesensitiseerd waren voor één of meerdere allergenen (zie Figuur 2). Bij multi-gesensitiseerde astmapatiënten was pre-BD-FEV1pp significant hoger dan bij aanvang vanaf 2 weken na de start van behandeling tot aan week 52 (p<0,001). Hetzelfde gold vanaf week 4 tot aan week 52 voor patiënten met sensitisatie voor een enkel allergeen (p<0,001). Bij patiënten zonder allergisch astma werd een trend van hogere pre-BD-FEV1pp gedurende de behandelperiode gezien, maar dit verschil was niet significant verschillend vergeleken met de start van de studie.
In deze post-hocanalyse werd gezien dat behandeling met dupilumab leidde tot een significante afname in het aantal ernstige exacerbaties bij kinderen van 6-11 jaar met ongecontroleerde, matig-ernstig tot ernstig astma met T2-inflammatie, die zijn gesensitiseerd voor een of meerdere allergenen. Daarnaast verbeterde dupilumab de longfunctie al vanaf enkele weken bij kinderen met allergisch astma. Deze verbeteringen in longfunctie bleken duurzaam en waren nog steeds aanwezig op week 52. Wegens de relatief kleine patiëntaantallen in de subgroepen zijn deze groepen verder niet onderling vergeleken.
Referentie
Hamelmann E. 001510 – Dupilumab Efficacy In VOYAGE Pediatric Patients With Uncontrolled, Moderate-to-Severe Type 2 Inflammatory Asthma By Allergen Sensitization Status. Gepresenteerd tijdens EAACI 2022; abstract 1510.
Bron foto: Leading-medicine-guide.com